1月10日,华海药业在互动平台表示,公司正积极配合辉瑞加速推进Paxlovid本土化项目的各项工作,以满足中国患者的新冠治疗需求。
此前,据彭博社消息称,辉瑞公司首席执行官艾伯乐(Albert Bourla)当地时间周一表示,中国市场对Paxlovid的需求猛增,导致供应紧张,他正在与中国的合作伙伴合作,从今年上半年开始在中国提供新冠口服药Paxlovid。他当日在旧金山举行的摩根大通医疗保健会议上透露,该合作伙伴的生产尚未开始,但很快会启动,“即使在未来3~4个月内就实现这个目标,我也不会感到意外。”不过他并未透露相关公司名称。
去年,A股原料药龙头华海药业(600521.SH)拿下了辉瑞Paxlovid的制剂委托生产协议,由华海药业在协议期内为辉瑞在中国大陆市场销售的Paxlovid提供制剂委托生产服务。其中,辉瑞提供奈玛特韦原料药与利托那韦制剂,华海药业负责奈玛特韦制剂生产,并完成组合包装。
1月9日,华海药业在回应媒体时称,目前公司在加速推进辉瑞产品本地化生产项目的各项工作,以保障Paxlovid在中国市场的充足供应,但目前Paxlovid本土化还没有批下来。
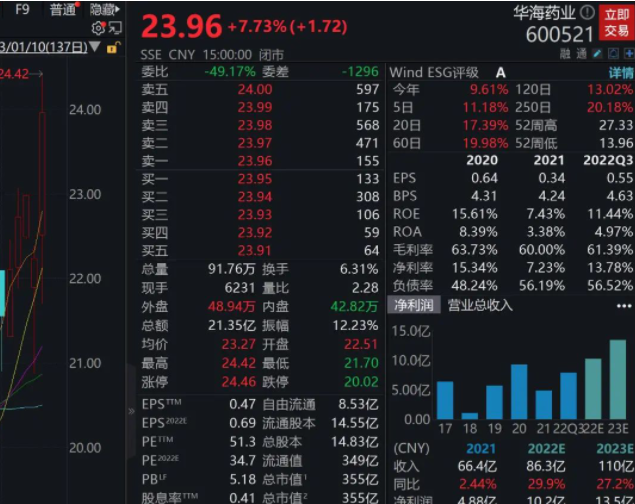
截至收盘,华海药业(600521.SH)涨近8%,报23.96元/股,总市值355亿元。
那么,Paxlovid要从进口产品转为本地化生产,需要经过哪些程序?这一过程大致需要多久完成?
我国目前实行MAH制度(药品上市许可持有人),何时进行生产取决于辉瑞何时拿到本地化生产许可证。
俄罗斯工程院外籍院士、昆翎医药联合创始人张丹向记者表示,辉瑞之所以选择进口转地产,是因为在国内生产可能会大幅降低成本。对于辉瑞而言,要实现在中国的本地化生产有两种路径选择。一是由辉瑞的在华子公司为代理;二是选择合作伙伴,例如华海药业为代理。
上述业内人士进一步分析,前一种方式为辉瑞自己的子公司持证,相当于华海药业仅赚取Paxlovid的加工费。而后者相当于辉瑞和华海药业的BD(商务拓展)合作,辉瑞将Paxlovid的相关专利、生产工艺、质量体系等都转卖给华海药业,由华海药业生产Paxlovid后,获取销售分成。
此前,1月9日,华海药业投资者关系部门相关人士在回应媒体时称,“医保是辉瑞在谈,公司只是给辉瑞做代工”。不过,上述业内人士认为,仅从商业合作的角度上看,选择后者的方式对辉瑞而言更加方便。因为按照现行规定,持证方需要自行负责产品的质量体系,放行检测等工作不可以外包。换而言之,授权给合作伙伴对于辉瑞而言减少了一些工作。而张丹指出,选择何种方式是出于公司的整体战略考量,外部人士难以预测。
在决定本地化生产方式后,辉瑞与合作伙伴还需要完成进口API(原料药)登记和补充产品验证性数据。这是为了来验证转为本地生产的产品与原来的进口产品是否完全一致,包括转交本地生产的API处方、生产工艺、质量系统等是否一致,本地生产的产品与进口产品在临床上的药效、安全性是否存在差异等。具体而言,对于一些结构简单、稳定、合成过程并不复杂的化药来说,通过溶出试验等体外试验就足以完成这一过程。而对于一些结构不稳定、合成工艺复杂、缓释制剂、吸入式药物等,则可能需要做临床试验。前者花费的时间一般在3至6个月,后者则相对繁琐,涉及临床批件、伦理审查等,需要半年至一年。
对于比对试验,上述业内人士认为,Paxlovid可能仅需完成体内外相关性(IVIVC)评价即可。其与验证性临床试验的区别在于,IVIVC评价入组的是健康人群,验证性临床试验入组的是相关患者。因此IVIVC评价完成难度更小、速度更快。但其认为,无论补充何种试验,由于Paxlovid的半衰期本身就很短,因此这一过程不会花很长时间。业内人士认为,若辉瑞的合作伙伴,如华海药业的工艺验证、清洁验证等都没有问题,也有空置的生产线专门用来生产相关产品,预计从申报到上市的时间大约在三到四个月。
香港大学李嘉诚医学院生物医学学院、病毒学专家金冬雁教授表示,Paxlovid患者在感染后的72小时内服用效果最好,若出现重症就没有太大价值,数据显示该药对65岁以上老人及有基础病的患者较为有效,能降低81%死亡率,但40-64岁年龄组没有明显获益。


